
這篇 2025 年由 International Society to Advance Alzheimer’s Research and Treatment (ISTAART) 發布的立場文章,正式宣告了阿茲海默症診斷思維的模式轉變(Model Shift)。
它打破了「無客觀缺損即無病」的傳統迷思,利用生物標記與影像證據,將主觀認知衰退(SCD)重新錨定為 AD 臨床第 2 期。
結論:要推動的不是「更早貼標籤」,而是「更早、更公平、更可行的主動腦健康管理」
6大提問
Q1:SCD 過去常被視為「正常老化」或「焦慮」,為何 2025 年這篇立場文件將其定義推向「阿茲海默症臨床第 2 期(Stage 2 AD)」?
Q2:SCD-plus” 特徵快速篩選出真正的高風險族群?
Q3:在缺乏客觀認知缺損的情況下,SCD 患者的大腦是否已出現可觀測的生物學改變?
Q4:SCD 患者未來演變成失智症的具體風險數據為何?這對臨床衛教有何意義?
Q5:除了昂貴的 PET 或 CSF,未來有哪些工具能讓基層醫師更有效地偵測 SCD?
Q6:隨著檢測技術進步,我們面臨什麼樣的倫理兩難(Ethical Dilemma)?
影片解說
https://www.youtube.com/watch?v=GVf_qNAdJso
Clinical definition, biological characterization, and detection guidelines of subjective cognitive decline due to Alzheimer's disease and related dementia: A position paper from ISTAART SCD PIA
文獻出處
背景
主觀認知衰退(SCD)被定義為:個人自覺認知能力下降,但在標準化測驗中仍屬正常範圍,且不應由急性醫療或精神事件直接解釋。
SCD 並非正式診斷,但常被放在正常老化與 MCI 之間的連續譜位置,尤其在具有特定危險因子或已存在阿茲海默症相關生物標記者,其臨床意義更受重視。
近年之所以重要,是因阿茲海默症被視為可長達數十年的疾病連續譜;SCD 可能提供早期偵測、介入與預防的關鍵窗口。
診斷複雜性與預後的高變異性
定義 SCD 的臨床架構
SCD 的臨床構念強調「相較以往的持續性下降」:多以記憶主訴為主,但並不限於記憶;認知測驗需以年齡/性別/教育校正後仍屬正常。
- 盛行率差異:根據不同定義與評估工具,SCD 在老年族群的盛行率差異極大,介於 19% 至 70% 之間。COSMIC 研究顯示約三分之一的老年人報告有持續性的認知擔憂。
文獻中 SCD 的量測極不一致:
參照時間(近幾週、半年、1 年、或「跟以前比」)
評估領域(只問記憶 vs 擴及注意力/語言/執行功能)
嚴重度與困擾程度是否被捕捉
這些差異會直接影響 SCD 與後續結果之關聯強度與可比性。
- 異質性:SCD 可能源自正常老化、焦慮、睡眠障礙、藥物影響,也可能是神經退化疾病的極早期。
SCD-plus 特徵:這些特徵包含:記憶特定的衰退、60 歲後發病、5 年內出現、伴隨擔憂、感覺比同儕差、持續存在、尋求協助、親友證實。
預測臨床進程
- 整體趨勢:SCD 並非必然進展,但平均而言,未來認知下降與臨床惡化風險上升。
轉變風險:SCD 患者進展為 MCI 或失智症的風險約為無症狀者的 2 倍。累積 4 年的轉變率,MCI 可達 27%,失智症可達 14%。
風險因子:高齡、女性、高教育程度、APOE ε4 攜帶者、生物標記陽性、以及伴隨憂鬱/焦慮症狀,皆會增加惡化風險。
親友證實的重要性:由配偶或親密親友證實的認知衰退,其預測價值高於患者單純自述。
微細客觀缺損:雖然定義上 SCD 無客觀缺損,但統合分析顯示,SCD 患者在整體認知、執行功能或記憶力上,其實已存在微小但在統計上顯著的差異,這可能反映了測試工具的天花板效應(Ceiling Effects)。
- 重要限制:相當比例 SCD 個體可多年穩定甚至緩解;僅靠一次橫斷評估或單一量表,難以準確區分良性擔憂與病理性軌跡。
評估與標準化的挑戰
工具缺乏標準化:目前缺乏黃金標準工具。現有量表(如 ECog, AD8, MAC-Q, CFI 等)在回溯時間(當下 vs. 過去一年)、評估領域(記憶 vs. 全局)與題數(單題 vs. 多題)上差異巨大。
相對「較能預測進展」的題項: 記憶特異擔憂、覺得比以前變差、以及對功能的影響。
多維度評估:整合:自述+親友/研究者觀察+脈絡因素(健康、精神症狀、用藥、壓力),並關注症狀「持續性」與縱向變化。
新興的大規模偵測工具
數位優勢:App 基礎的認知任務與被動行為監測,能在居家環境提供高頻率評估,捕捉傳統測驗遺漏的波動。
線上篩檢:如 Brain Health Registry 使用的網路版 ECog 已顯示出預測價值。
臨床路徑整合:當數位工具顯示顯著衰退(如 ECog 顯示持續比 10 年前差且伴隨擔憂)或符合多項 SCD-plus 特徵時,應轉介進行面對面神經心理測驗或生物標記檢查。
SCD 與早期神經生物學變化
生物標記與神經影像關聯
- 類澱粉:在 SCD 階段最一致、最常見的生物學訊號
在 SCD 族群中,類澱粉 PET 與腦脊髓液(CSF)檢測顯示:類澱粉沉積與更高 SCD 程度相關,且在 SCD 的比例通常高於認知正常對照,尤其在符合 SCD-plus 特徵者更明顯。
Tau:較不一致,但在「高風險 SCD」可用 tau-PET 看見
Tau 病理在 SCD 階段的偵測「較不穩定」,但在高風險者可透過 tau-PET 看到。
- 結構/代謝/連結性:出現「非常細微但符合阿茲海默症脆弱區」的改變
MRI:內側顳葉(尤其海馬迴)、楔前葉、眶額皮質等區域可見細微萎縮。
DTI、FDG-PET:白質完整性改變與顳頂葉/後扣帶迴低代謝。
fMRI:預設模式網路、執行控制網路、顯著性網路等連結性/活化改變,可能反映代償或早期失衡。
EEG/MEG:慢波增加與同步性破壞,符合早期神經生理改變
SCD 在 AD 生物分期模型中的定位
Stage 2 AD:在 NIA-AA 與 IWG 的框架下,SCD 加上生物標記陽性(Amyloid/Tau+),即使認知測驗正常,也被定義為 AD 臨床第 2 期(第 1 期為無症狀生物標記陽性,第 3 期為 MCI)。
血漿標記前景:雖然僅約 1-2% SCD 符合完整 ATN 標準,但約 20% 呈現 Aβ 陽性。血漿標記(如 p-tau, Aβ42/40)提供了一個具成本效益的篩檢工具。
可修正影響因子與社會心理層面
心理健康與人格特質的角色
雙向關係:憂鬱、焦慮與神經質(Neuroticism)人格與 SCD 高度相關。這些症狀既可能是 SCD 的干擾因子(Noise),也可能是神經退化的早期表現(Prodrome)。
- 憂鬱:憂鬱症狀常與更高 SCD 程度、困擾、求助、功能受影響相關,即便客觀測驗仍正常。
加成風險:當情緒障礙與 SCD 共存,或在客觀缺損出現前發生,往往預示著更高的退化風險。
社會與結構性決定因子
社會決定因素:教育、社經地位與慢性壓力影響症狀表達。文化差異可能導致某些族群的症狀被忽視。
研究缺口:現有研究多集中於高教育、白人族群,缺乏種族與文化多樣性,這限制了預測模型的通用性。
SCD 階段的介入策略
非藥物預防行動的窗口
介入時機:SCD 患者通常具備高健康意識與求知慾,
是導入生活型態介入的最佳時機。
- FINGER、MAPT 等研究,強調多領域生活型態介入(運動、認知訓練、飲食、心血管風險管理)能在高風險老年人中維持或提升認知。
正念與心理介入:正念(Mindfulness)療法顯示能改善心理健康並減少與情緒相關的 SCD 主訴。
風險揭露的不確定性和倫理議題
揭露的兩難:許多 SCD 患者渴望知道風險,但揭露生物標記結果需配合完整的衛教與支持,以免造成心理創傷。
- 潛在傷害包括:污名、保險歧視、過度醫療化;因此需要清楚指引、醫護訓練、以及完整支持架構,避免早期偵測「帶來傷害而非行動」。
告知本身會改變日後 SCD 的自述(知道自己高風險後更容易注意與回報),會干擾縱向追蹤解讀。Clinical definition, biological…
臨床試驗目標:SCD 且生物標記陽性者,應成為疾病修飾治療(DMT)臨床試驗的主要招募對象。
優化 SCD 評估與管理
關鍵缺口與未來方向
推廣統一標準(SCD-plus)。
整合生物標記進行精準風險分層。
釐清心理健康與 SCD 的因果關係。
擴大研究族群的多樣性。
開發針對 SCD 的非藥物介入策略。
建立生物標記結果揭露的倫理指引。
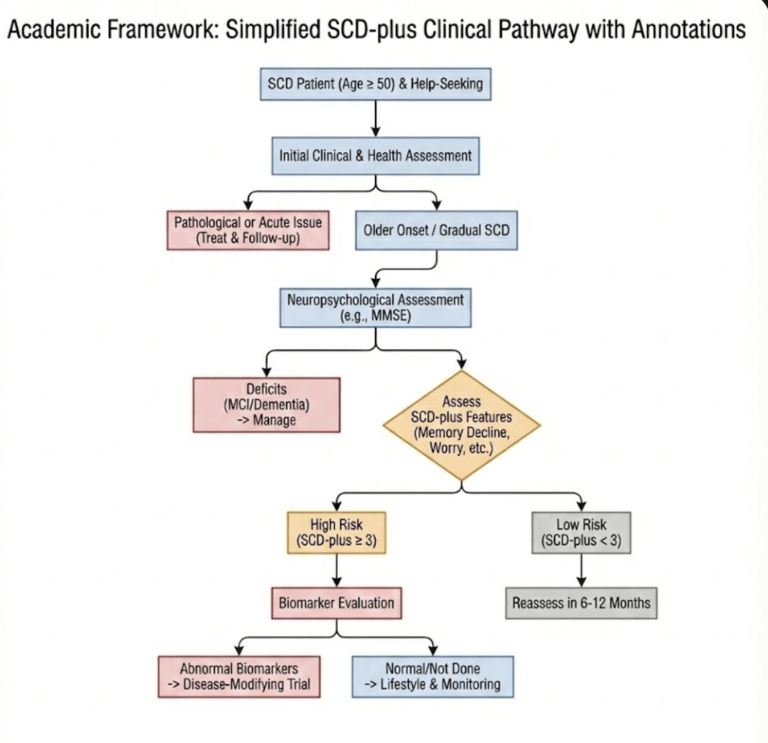
臨床實務的結構化框
初評:病史詢問,排除急性醫療事件、精神疾病或藥物影響。
若 SCD 與 6 個月內急性事件時間相關,短期監測與支持性照護可能更合適。
神經心理測驗:若測驗有缺損 → 導向 MCI/失智症路徑。
若測驗正常:評估 SCD-plus 特徵。
SCD-plus < 3 項:6-12 個月後重新評估。
SCD-plus $\ge$ 3 項:建議進行生物標記評估(需共同決策與衛教)。
生物標記結果:
異常:建議參加臨床試驗或密切監測。
正常:建議生活型態介入。
核心原則:無論路徑為何,持續的縱向追蹤(Longitudinal monitoring)與數位監測是關鍵。
個人想法
- 由於抗類粉藥物的出現,如何找到阿茲海默症早期,症狀尚不明顯的病人來開始治療,成了接下來臨床醫師要面臨的挑戰。
- 自覺認知衰退 (SCD)一直是臨床上的難題,所有臨床上可用的檢查都幾乎完全正常,但他們卻信誓旦旦的表示,我的記憶力真的和幾年前比差很多,現在多了生物標記的檢查這個工具。
- 當 SCD 伴隨生物標記陽性時,即為 AD 臨床第 2 期 (Stage 2 AD) 。這證實了我們長久以來的臨床直覺——病人的主觀感受往往比我們的客觀量表更早偵測到大腦的微細變化 。
- 但生物標記的正確性和如何解讀,以及如何配合上臨床症狀和患者個人的人格心理特質來做解釋,是失智專科醫師要注重和學習的重點。
- 目前的疾病修飾藥物(DMT)主要適應症仍集中在 MCI 或輕度失智症階段 。而SCD伴隨生物標記陽性的這群人處在一個尷尬的「治療空窗期」——我們只能告訴病人「你有風險」,但目前確仍無有確實臨床證據有效的藥物武器來即時逆轉 。而且目前接受這一類藥物治療仍要面臨有一定比例副作用的風險,在風險評估上也難有結論。
重點問答
Q1:SCD 過去常被視為「正常老化」或「焦慮」,為何 2025 年這篇立場文件將其定義推向「阿茲海默症臨床第 2 期(Stage 2 AD)」?
A: 這代表了臨床診斷思維的重大模式轉變(Model Shift)。過去我們習慣等到客觀檢測出現異常(MCI)才介入,但根據 NIA-AA 與 IWG 的最新框架,AD 是一個連續體。本篇論文強調,當患者出現主觀認知功能衰退(SCD),且伴隨 AD 生物標記(如 Amyloid/Tau)陽性時,即使神經心理測驗分數正常,在生物學上已可被定義為 「阿茲海默症臨床第 2 期(Stage 2 AD)」。這意味著 SCD 不再只是排除診斷後的剩餘選項,而是大腦神經網絡在代償機制瀕臨極限時發出的早期病理訊號,是進行疾病修飾治療(DMT)與生活型態介入的黃金窗口。
Q2:面對門診大量主訴「健忘」的患者,如何利用 “SCD-plus” 特徵快速篩選出真正的高風險族群?
A: 由於 SCD 異質性極高,為了從「雜訊」中過濾出「訊號」,SCD-I(SCD-Initiative)提出了 “SCD-plus” 特徵。研究證實,具備越多以下特徵的個案,其背後隱藏 AD 病理變化及未來退化的風險越高:
發病年齡 > 60 歲。
症狀在過去 5 年內出現。
對症狀感到持續性的擔憂(Worry/Concern)。
感覺比同齡人差。
症狀持續存在。
尋求醫療協助。
親友證實(Corroboration by informant):這一點權重極高,旁人觀察到的衰退往往比單純自述更具預測力。
Q3:在缺乏客觀認知缺損的情況下,SCD 患者的大腦是否已出現可觀測的生物學改變?
A: 是的,影像學與生物標記研究揭示了「冰山下」的變化。即使認知測驗正常,SCD 患者(特別是符合 SCD-plus 者)大腦中出現 Amyloid-β 沉積 的比例顯著高於無症狀對照組。結構性 MRI 顯示海馬迴、楔前葉(precuneus)與額葉眼眶面(orbitofrontal cortex)已出現微細萎縮。此外,功能性 MRI(fMRI)發現預設模式網絡(DMN)的連結改變,這可能反映了早期的代償作用或神經網絡失效。這些證據支持 SCD 是神經退化過程的早期臨床表現。
Q4:SCD 患者未來演變成失智症的具體風險數據為何?這對臨床有何意義?
A: 數據顯示 SCD 患者面臨顯著升高的惡化風險。統合分析指出,SCD 患者進展為 MCI 或失智症的機率約為無症狀者的 2 倍。在高風險世代中,每年轉變為 MCI 的比率約為 7%,轉變為失智症的比率接近 2%。然而,臨床溝通需謹慎,因為仍有顯著比例(如 15 年追蹤下有 40%)的患者保持穩定甚至症狀緩解。因此,風險分層(Risk Stratification)至關重要,需結合年齡、APOE 基因型與生物標記來評估個別預後。
Q5:除了昂貴的 PET 或 CSF,未來有哪些工具能讓基層醫師更有效地偵測 SCD?
A: 論文強調了 數位工具(Digital Tools) 與 血漿生物標記(Plasma Biomarkers) 的潛力。
數位工具:透過智慧型手機進行高頻率、居家環境下的認知測試(如 app-based tasks)或被動行為監測,能捕捉到傳統單次門診測試遺漏的微細波動。
血漿標記:隨著檢測技術進步,血漿 Aβ42/40 比值或 p-tau 等高性價比工具,將成為篩檢 SCD 族群中 AD 病理的重要手段,大幅降低早期偵測的門檻。
Q6:隨著檢測技術進步,我們面臨什麼樣的倫理兩難(Ethical Dilemma)?
A: 當我們能在 SCD 階段(甚至認知功能尚可時)就偵測出 AD 病理風險,「告知」本身可能是一把雙面刃。雖然部分患者希望知情以規劃未來,但過早標籤化可能導致「預期性焦慮」、保險歧視或不必要的醫療化。更有趣的是,告知風險本身可能會改變患者對自身認知的監控,進而增加 SCD 的報告頻率,干擾後續追蹤。因此,論文強烈建議在揭露生物標記結果前,必須建立標準化的諮商流程與心理支持系統。